全球首个免疫疗法 阿斯利康Imfinzi再获积极生存数据
近日,阿斯利康及旗下全球生物制剂研发部门MedImmune在第19届世界肺癌大会上公布了PD-L1肿瘤免疫疗法Imfinzi的III期临床研究PACIFIC的更新数据。

该研究是一项随机、双盲、安慰剂对照、多中心研究,评估了Imfinzi用于治疗接受含铂化疗和放疗(CRT)后病情没有进展的不可切除性、III期(局部晚期)非小细胞肺癌(NSCLC)“all-comer”患者(例如,不论PD-L1状态如何)的疗效和安全性。该研究在26个国家的235个医疗中心开展,涉及713例患者。研究的主要终点是无进展生存期(PFS)和总生存期(OS),次要终点包括标志性PFS和OS、客观缓解率、缓解持续时间等。(所谓的“all comer”患者,是指符合研究协议的所有患者,而不是严格挑选的患者,更加贴近真实世界的临床实践模式,其结果也更具有普遍性。)
在首次中期分析时,与安慰剂相比,Imfinzi使患者PFS显著延长了11.2个月(中位PFS:16.8个月[95%CI:13.0-18.1] vs 5.6个月[95%CI:4.6-7.8];疾病进展或死亡风险风分层HR=0.52,95%CI:0.42-0.65,p<0.001)。
此外,PFS、其他有意义的次要疗效终点(包括发生远端转移或死亡、新发病灶、第二次病情进展或死亡[PFS2]时间、总缓解率)及安全终点的最新结果:
1)OS:与安慰剂,Imfinzi显著延长了OS、使死亡风险显著降低了32%(分层的死亡风险比=0.68,95%CI:0.47-0.997,p=0.0025)。在横跨所有预先指定的患者亚组中,均观察到了Imfinzi的总生存受益,包括基于人口学特征、基线临床病例特征、对先前治疗的反应等等。具体数据为,12个月总生存率方面,Imfinzi治疗组为83.1%(95%CI:79.4-86.2),安慰剂组为75.3%(95%CI:69.2-80.4)。24个月总生存率方面Imfinzi治疗组为66.3%(95%CI:61.7-70.4),安慰剂组为55.6%(95%CI:48.9-61.8)数据具有统计学显著差异(双臂p=0.005)。

OS数据分析结果
2)更新的PFS数据:与安慰剂相比,Imfinzi使患者PFS显著延长了11.6个月(中位PFS:17.2个月[95%CI:13.1-23.9] vs 5.6个月[95%CI:4.6-7.7];分层的疾病进展或死亡风险比HR=0.51,95%CI:0.41-0.63,p<0.001)。
3)死亡或远端转移:与安慰剂组相比,Imfinzi治疗组死亡或远端转移时间延长(中位数:28.3个月[95%CI:24.0-34.9] vs 16.2个月[95%CI:12.5-21.1],分层风险比=0.53[95%CI:0.41-0.68])。
4)新病灶的出现频率:Imfinzi治疗组为22.5%,安慰剂组为33.8%;此外,Imfinzi治疗组新发脑转移发生率低于安慰剂组(6.3% vs 11.8%)。
5)PFS2方面:此外,与安慰剂组相比,Imfinzi治疗组PFS2时间延长(中位PFS2:28.3个月[25.1-34.7] vs 17.1个月[95%CI:14.5-20.7],分层风险比=0.58[95%CI:0.46-0.73])。第一次后续治疗或死亡事件以及第二次后续治疗或死亡时间方面Imfinzi治疗组也比安慰剂组长。
6)总缓解率:Imfinzi治疗组为30.0%(95%CI:25.8-34.5),安慰剂组为17.8%(95%CI:13.0-23.6),数据具有统计学显著差异(p<0.001)。中位缓解持续时间方面,Imfinzi治疗组尚未达到(95%CI:27.4-NR),安慰剂组为18.4个月(95%CI:6.7-24.5)。病情实现缓解的患者中,Imfinzi治疗组有73.5%的患者在第18个月时仍然持续缓解,安慰剂组比例为52.2%。
7)安全性:至新的数据截止日期为止,Imfinzi治疗组和安慰剂组的安全性概况与之前的报告中一致。
阿斯利康全球药物开发执行副总裁兼首席医疗官Sean Bohen表示,这些数据证实了Imfinzi作为首个肿瘤免疫疗法治疗接受化疗后的不可切除性III期NSCLC患者的总生存受益。在临床治疗方面,该类患者在过去几十年来的生存率一直没什么起色,接受化疗后的5年生存率仅为15%。今天公布的显著生存受益数据为患者带来了新的希望,同时提供了信心和明确的理由,Imfinzi将成为这类患者临床治疗的新护理标准。
Imfinzi:全球首个III期不可切除性NSCLC的肿瘤免疫疗法,年销或40亿美元
基于该研究的首次中期分析数据,Imfinzi之前已获美国、加拿大、瑞士、印度、日本、巴西批准,并于近日获得欧盟批准,成为这些国家和地区首个也是唯一一个获批治疗局部晚期(III期)、不可切除性NSCLC的肿瘤免疫疗法,具体用于接受含铂化疗和放疗联合治疗病情没有改善的患者。此外,Imfinzi也已获美国、加拿大、巴西、以色列、中国香港、印度批准,用于治疗晚期或转移性尿路上皮癌(mUC)。
此次公布的OS数据对阿斯利康至关重要。根据该公司2018Q2报告,Imfinzi在Q2的销售额仅为1.22亿美元。有分析师认为,此次III期不可切除性NSCLC的OS数据,将大幅提振Imfinzi的销售额,其2023年的全球销售额有望达到40亿美元。

III期(局部晚期)NSCLC通常分为3个亚类(IIIA,IIIB,IIIC),由肿瘤在局部扩散的程度和手术的可能性来定义。III期不同于IV期,后者是癌症已扩散(转移)到远处器官,而目前III期的治疗目的是治愈。
据估计,III期NSCLC约占NSCLC发病率的三分之一,在2017年约影响全球8大国家(中国、法国、德国、意大利、日本、西班牙、英国、美国)约10.5万人口。III期NSCLC患者中大部分被确诊为不可切除性肿瘤。过去几十年来,在临床治疗方面,除了标准的治疗方案即化-放疗后进行主动监测以监视病情进展,除此之外没有新的治疗方法。但这一疾病的预后并不理想,长期生存率也很低。
Imfinzi(durvalumab)是一种PD-L1肿瘤免疫疗法,靶向结合细胞程序性死亡因子配体1(PD-L1),阻断PD-L1与PD-1和CD80的相互作用,对抗肿瘤的免疫逃避策略并释放对免疫应答的抑制作用。目前,阿斯利康正在开展一个大型临床项目,其中一部分研究正在评估Imfinzi作为单药疗法以及联合化疗、放疗、小分子药物和抗CTLA4单克隆抗体(tremelimumab),作为一线或二线治疗药物,用于NSCLC、小细胞肺癌(SCLC)、局部晚期或转移性尿路上皮癌、头颈癌及其他实体肿瘤的治疗。(新浪医药编译/newborn)
文章参考来源:
1、Imfinzi is the first immunotherapy to demonstrate significant overall survival benefit in unresectable, Stage III lung cancer
2、Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC
3、AstraZeneca’s Imfinzi Cuts Lung Cancer Death by a Third
- 礼进生物将在2023 ASCO上报告4-
礼进生物将在2023年美国临床肿瘤学会 (ASCO) 年会上...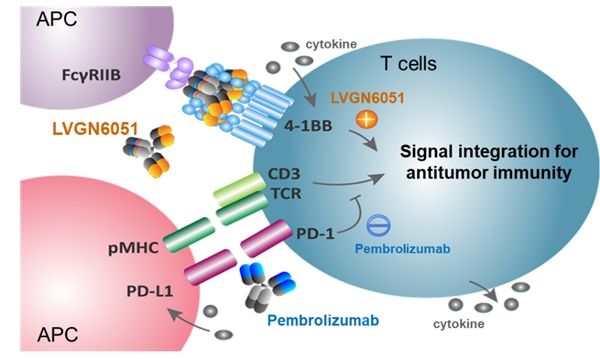
- 脑静脉血栓实现智能化诊断,脑卒中AI研究
近日,推想医疗与首都医科大学附属北京朝阳医院放射科杨旗教授团...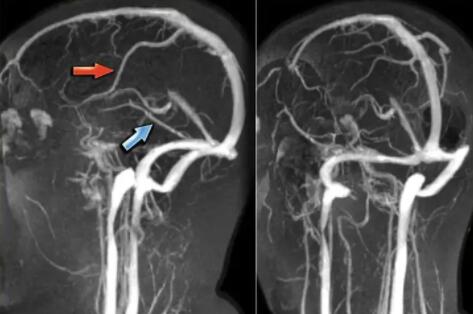
- 科兴制药产业布局再发力 探索合成生物技术
11月2日,科兴制药(股票代码:688136)发布公告,公司...
- 拜耳转移乳腺癌ErSO疗法尚未进入临床试
此前有报道称拜耳一种小分子药物ErSO对动物体内的癌细胞有9...