2018年FDA批准的孤儿药新药盘点
作者:绿萝
2018年截止11月30日,FDA关于孤儿药新药的批准有45项,涉及43个药品(其中有2项为同一药品不同剂型),与过去9年相比,虽然2018年还未完结,但批准数量已经创历史新高。
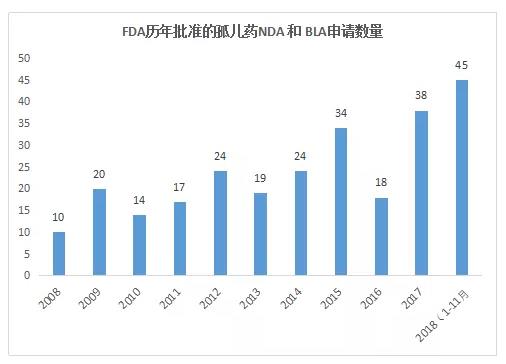
数据来源:药智美国FDA药品数据库
其每月获批情况如下图所示,在8月获批数量最多,7、9、11月次之。
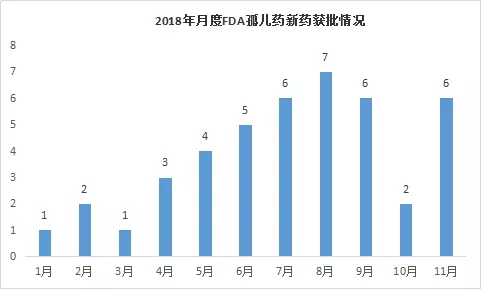
数据来源:药智美国FDA药品数据
在这45项批准中,有9项为生物制品许可申请(BLA),36项为新药上市许可申请(NDA),NDA申请中有21项(20个药品)为新分子实体(NME,New Molecular Entity),3项为新分子实体及新药物组合,7项为新剂型,3项为新配方或新生产者。以下分别来看看生物制品及化药新分子实体、新分子实体及药物组合药物的具体情况。(文末附完整名单)
BLA申请
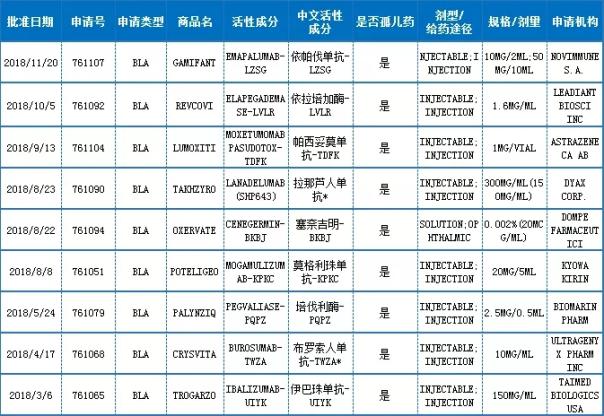
注:中文活性成分,依据INN命名原则翻译而来,“*”号部分翻译还有待商榷
数据来源:药智美国FDA药品数据库
Gamifant(emapalumab)
11月20日,FDA批准Novimmune SA公司的新药Gamifant上市,该药是一种干扰素γ(INFγ)阻断抗体,用于难治性、复发性或进展性疾病或对常规HLH疗法不耐受的原发性噬血细胞性淋巴组织细胞增多症(HLH)儿童(新生儿及以上)和成人患者的治疗。Gamifant是FDA批准的首例针对HLH的疗法,也是全球首个,是原发性HLH临床治疗领域24年来的首个重大突破。HLH是一种非常罕见的高发病率和高死亡率的高度炎症综合征。
Revcovi(elapegademase-lvlr)
10月5日,FDA批准Leadiant Biosciences公司的新药Revcovi上市,该药用于治疗小儿和成人患者的重症联合免疫缺陷症(ADA-SCID)。ADA-SCID是一种罕见遗传病,发病率很低,是由于患者编码腺苷脱氨酶(ADA, Adenosine Deaminase)的基因出现突变失去原有功能而导致,会使得患者的免疫功能几乎完全丧失,往往出生一年内即可出现严重的临床病症。
Lumoxiti(moxetumomab pasudotox-tdfk)
9月13日,FDA批准阿斯利康(AstraZeneca)公司的新药Lumoxit上市, 用于治疗复发性或难治性毛细胞白血病(hairy cell leukemia, HCL)成人患者。这些患者已经至少接受过两种全身性治疗,其中包括嘌呤核苷类似物(purine nucleoside analog)疗法。该药是一种靶向CD22的重组免疫毒素,是治疗HCL患者的第一例细胞毒素疗法。HCL是一种罕见的,生长缓慢的血癌,它是由于骨髓生成过多的B淋巴细胞而造成的。HCL可能导致严重甚至致命的健康状况,包括感染、出血和贫血。
Takhzyro(lanadelumab-flyo)
8月23日,FDA批准Shire旗下Dyax Corp公司的新药Takhzyro上市,该药是一种可特异性结合并抑制血浆激肽释放酶的单克隆抗体,用于预防12岁及以上患者遗传性血管水肿(HAE)的发作。HAE是一种罕见的遗传病,任何年龄阶段均可能发病,但在儿童或青少年时期较常见。主要表现为反复发生的皮肤、呼吸道和内脏器官肿胀,当水肿发生于气道时,可致喉水肿,如果抢救不及时,可窒息死亡。
Oxervate (cenegermin-bkbj)
8月22日,FDA批准意大利生物制药公司Dompe的新药Oxervate上市,该药用于治疗成人中度至重度神经营养性角膜炎(neurotrophic keratitis,NK)。且该药是FDA在批准的第一款治疗中重度神经营养性角膜炎的药物,此前,在2017年的7月该药已经于欧盟获批。NK是一种罕见的致残性、退行性眼科疾病,发病率低于万分之五,该病导致角膜上皮细胞损伤和角膜敏感度丧失,在更严重的情况下可引起角膜溃疡、角膜融解和穿孔,严重影响患者视觉能力,甚至导致失明。
Poteligeo(mogamulizumab-kpkc)
8月8日,FDA批准Kyowa Kirin公司的新药Poteligeo上市,该药是一种人源化CC趋化因子受体4(CC chemikon receptor 4, CCR4)单克隆抗体。用于治疗已经接受过至少一次全身性疗法的复发或难治性蕈样真菌病(mycosis fugoides, MF)或塞扎里综合症(Sezary syndrome, SS)成年患者。是FDA第一次批准针对SS的药物。
Palynziq(pegvaliase-pqpz)
5月24日,FDA批准了BioMarin Pharmaceutical公司的新药Palynziq上市,该药用于用于苯丙酮酸尿症(PKU)成人患者,PKU 是一种罕见而严重的遗传性疾病。这是首个获批能通过帮助身体分解Phe来靶向PKU潜在病因的酶替代疗法。也是BioMarin公司针对这一重要病症的第二款批准疗法。
Crysvita(burosumab)
4月17日,FDA批准Ultragenyx Pharmaceutical公司的新药Crysvita上市,该药为首个获批治疗1岁及以上儿童和成年人的X连锁低磷血症(XLH)的药物。XLH是一种严重的罕见的遗传性软骨病,会造成血液中磷含量低,导致儿童和青少年的骨骼生长和发育受损,并使其一生都有骨矿化的问题。
Trogarzo (ibalizumab-uiyk)
3月6日,FDA批准中国台湾公司中裕新药股份有限公司(TaiMed Biologics)的新药Trogarzo (ibalizumab-uiyk)上市,Trogarzo是一种新型的抗逆转录病毒药物,适用于那些已对惯用药产生耐药性的成年艾滋病患者:那些曾尝试过多种药物但其HIV病毒的感染水平无法被有效降低或控制的成人患者,使用方法每14天静脉内注射一次。Trogarzo是HIV治疗领域第一个被批准上市的单克隆抗体蛋白药物,也是第一个HIV长效新药。获得美国FDA颁发的突破性疗法认定、孤儿药资格。此外Trogarzo的生产商为药明生物,使其也成为了中国有史以来第一款在本土生产,在美国销售的全球创新药物。
NDA申请-新分子实体
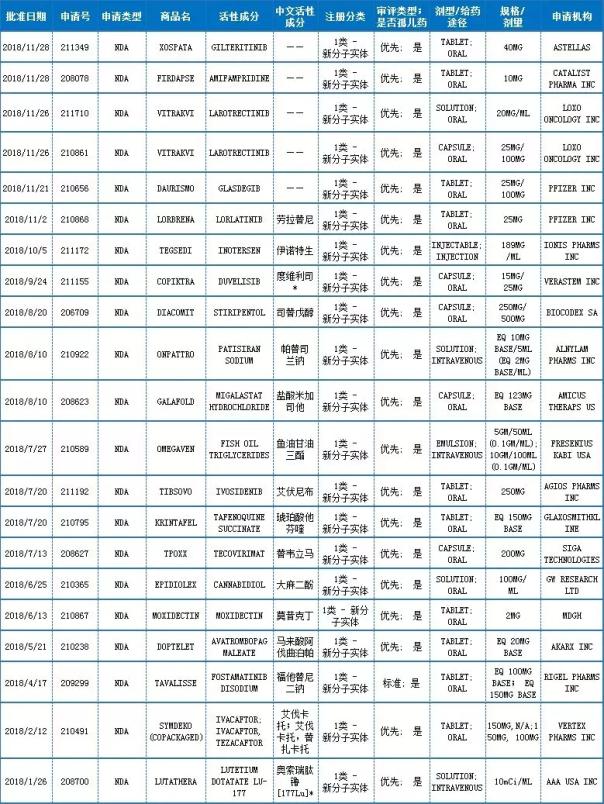
注:中文活性成分,依据INN命名原则翻译而来,“*”号部分翻译还有待商榷
数据来源:药智美国FDA药品数据库
Xospata(gilteritinib)
11月28日,FDA批准安斯泰来(Astellas)公司的新药Xospata上市,用于经FDA批准的一种检测方法证实存在FLT3突变的复发性或难治性(药物难治)急性髓性白血病(AML)成人患者的治疗。该药成为 FDA批准用于复发性或难治性AML患者群体的首个也是唯一一个FLT3靶向制剂。
Firdapse (amifampridine)
11月28日,FDA批准Catalyst Pharma公司的新药Firdapse上市,用于治疗成人Lambert-Eaton肌无力综合征(LEMS)。该药是FDA批准的第一种LEMS治疗方法。LEMS是一种罕见的自身免疫性疾病,影响神经和肌肉的连接,破坏神经细胞向肌肉细胞发送信号的能力,并导致虚弱和其他症状。
Vitrakvi (larotrectinib)
11月26日,FDA批准Bayer(拜耳)和Loxo Oncology共同研发的“广谱”抗癌药Vitrakvi两种剂型(口服溶液剂口服胶囊剂)上市,用于治疗携带NTRK基因融合((gene fusion))的成人和儿童,局部晚期或转移性实体瘤患者,并且没有产生已知的抗性突变,是转移性的或手术切除可能导致严重发病率,没有有效替代治疗方案。Vitrakvi是第一个正式批准上市的口服TRK抑制药物,同时也是第一个与肿瘤类型无关的“广谱”抗癌药。
Daurismo (glasdegib)
11月21日,FDA批准辉瑞(Pfizer)公司的新药Daurismo上市,与低剂量阿糖胞苷(LDAC)化疗联用,治疗新确诊的75岁以上,或因慢性健康问题和疾病无法使用高强度化疗的急性骨髓性白血病(AML)患者。AML是一种血液癌症,病情进展迅速。这一疾病预后较差,大部分患者会最终出现疾病复发,他们的治疗前景也极不乐观。
Lorbrena (lorlatinib)
11月2日,FDA批准辉瑞(Pfizer)公司的新药Lorbrena上市,此药为第三代ALK抑制剂,用于治疗ALK阳性转移性非小细胞肺癌(NSCLC)患者。这些患者在接受克唑替尼或者至少一种其它ALK抑制剂治疗后疾病继续恶化,或者接受alectinib或ceritinib作为第一种ALK抑制剂疗法后疾病继续恶化。
Tegsedi (inotersen)
10月5日,FDA批准美国生物制药公司Ionis Pharmaceuticals的新药Tegsedi(inotersen)上市,用于遗传性转甲状腺素蛋白淀粉样变性(hATTR)成人患者,治疗其第1阶段或第2阶段多发性神经病变。hATTR是一种罕见遗传疾病,hATTR不仅严重影响生活质量,而且致死性很高。
Copiktra(duvelisib)
9月24日,FDA批准Verastem公司的新药Copiktra上市,用于既往至少有过两种治疗的复发或难治性慢性淋巴细胞性白血病(CLL) / 淋巴细胞性淋巴瘤(SLL)。这款药物是一种磷脂酰肌醇 3 激酶(PI3K)抑制剂,是首个获批的PI3K-delta和PI3K-gamma双重抑制剂。
Diacomit(stiripentol)
8月20日,FDA批准Biocodex公司的新药Diacomit上市,用于治疗2岁或2岁以上正在服用氯巴占的Dravet综合症患者的癫痫发作。Dravet综合征又称为婴儿严重肌阵挛性癫痫(,SMEI),是一种罕见的、严重的遗传性脑病,具有发病年龄早、发作形式复杂、发作频率高、智能损害严重、药物治疗有效率低、预后差、死亡率高等特点。
Onpattro(patisiran)
8月10日,FDA批准Alnylam公司的新药Onpattro上市,用于治疗转甲状腺素蛋白淀粉样变性(hATTR,也称家族性淀粉样多发性神经病变,FAP)引起的神经损伤。这是FDA批准的首款RNAi药物,也是第一个上市用于治疗hATTR的药物。
Galafold(migalastat)
8月10日,FDA批准了Amicus Theraps公司的新药Galafold上市,用于体外检测证实存在特定α-半乳糖苷酶基因突变的法布里病成人患者,Galafold是美国首个治疗法布里病的口服药物。
Omegaven(fish oil triglycerides)
7月27日,FDA批准Fresenius Kabi公司的新药Omegaven上市,作为罹患“肠外营养相关胆汁淤积”的儿童患者的卡路里与脂肪酸补充剂。
主要脂肪酸组分的分子量及化学结构:
Tibsovo(ivosidenib)
7月20日,FDA批准Agios的新药Tibsovo上市,用于治疗患有复发性或难治性急性骨髓性白血病(R/R AML)的成人患者。Tibsovo为FDA批准的首个也是目前唯一一个治疗IDH1突变R/R AML的药物。AML是成人中最常见的急性白血病,特征是疾病进展迅速。大多数AML患者最终会复发。此外值得提及的是在中国,2018年6月基石药业与Agios签署独家合作与授权协议,获得Tibsovo在大中华区的独家权利。
Krintafel(tafenoquine)
7月20日,FDA批准葛兰素史克(GSK)公司的新药Krintafel上市,用于正在接受适当抗疟药物治疗急性间日疟原虫感染的16岁及以上疟疾患者,根治(预防复发)由间日疟原虫导致的疟疾。Krintafel为60多年来首个治疗间日疟原虫疟疾的新药,对于患者来说是一个重要的里程碑。
Tpoxx(tecovirimat)
7月13日,FDA批准SIGA Technologies公司的新药Tpoxx上市,用于治疗天花。天花是一种传染性疾病,有时甚至可以致命,世界卫生组织虽然在 1980 年就宣布已消除天花这种疾病,但人们对其仍有担忧,因此仍旧开发能治疗天花的药物。
Epidiolex(cannabidiol)
6月25日,FDA批准GW公司的新药Epidiolex上市,用于适用于2岁及以上患者,治疗两类罕见而严重的癫痫Lennox-Gastaut综合征(LGS)与Dravet综合征(DS)。该药是首款FDA批准上市的含纯化大麻提取物的新药,也是首款获批用于治疗Dravet综合征的疗法。据悉FDA此前对Epidiolex已授予4种适应症的孤儿药资格,包括LGS、DS、结节性硬化症(TSC)和婴儿痉挛(IS)。
Moxidectin(Moxidectin)
6月13日,FDA批准MDGH公司的新药Moxidectin上市,用于12岁及以上患者的盘尾丝虫病感染治疗。盘尾丝虫病是旋盘尾线虫寄生于人体皮肤、皮下组织和眼部所致苔藓样皮炎、皮下结节和视力障碍为特征的寄生虫病,又称河盲症或瞎眼丝虫病。广泛流行于非洲和热带美洲,在流行区可造成5%~20%的成人失明。
Doptelet(avatrombopag)
5月21日,FDA批准AkaRx公司的新药Doptelet上市,用于治疗计划接受医疗或牙科手术的慢性肝病(CLD)成人患者的血小板减少症。这是FDA批准的首款用于该适应症的药物。
Tavalisse (fostamatinib)
4月17日,FDA批准Rigel公司的新药Tavalisse上市,用于治疗对先前治疗无效的成人慢性免疫性血小板减少症(ITP)。慢性ITP是一种罕见的自身免疫性疾病。
Symdeko(Tezacaftor/Ivacaftor)
2月12日,FDA批准Vertex公司的新药Symdeko上市,用于治疗12岁及以上的囊性纤维化患者。该药为FDA批准的第3种针对囊性纤维化根本病因的治疗药物。囊性纤维化是一种罕见的会缩短寿命的遗传疾病,由基因突变导致的CFTR蛋白缺陷或缺失引起。
Lutathera(lLu177dotatate)
1月26日,FDA批准诺华子公司法国Advanced Accelerator Applications 公司的Lutathera用于生长抑素受体阳性胃肠胰腺神经内分泌肿瘤成人患者的治疗。该药在美国和欧盟均被授予孤儿药地位,欧盟于2017年10月批准上市。
结构式:
NDA申请-新分子实体;新药物组合
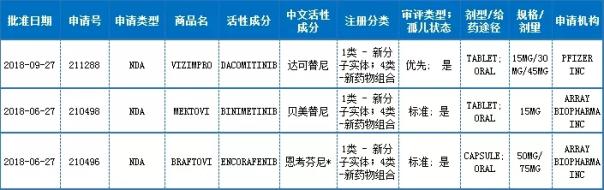
注:中文活性成分,依据INN命名原则翻译而来,“*”号部分翻译还有待商榷
数据来源:药智美国FDA药品数据库
Vizimpro
9月27日,FDA批准辉瑞(Pfizer)公司的新药Vizimpro上市,用于一线治疗EGFR第19号外显子缺失或21号外显子L858R突变的转移性非小细胞肺癌(NSCLC)患者。这是已批准的第二代EGFR靶向药物。
Braftovi ( encorafenib )/Mektovi ( binimetinib )
6月27日,FDA批准Array BioPharma公司的组合疗法Braftovi+Mektovi上市,用于治疗BRAF V600E或BRAF V600K突变的不可切除或转移性黑色素瘤患者。值得注意的是,Braftovi不适用于野生型BRAF黑色素瘤的治疗。
附:2018年FDA批准的孤儿药(截止11月30日)
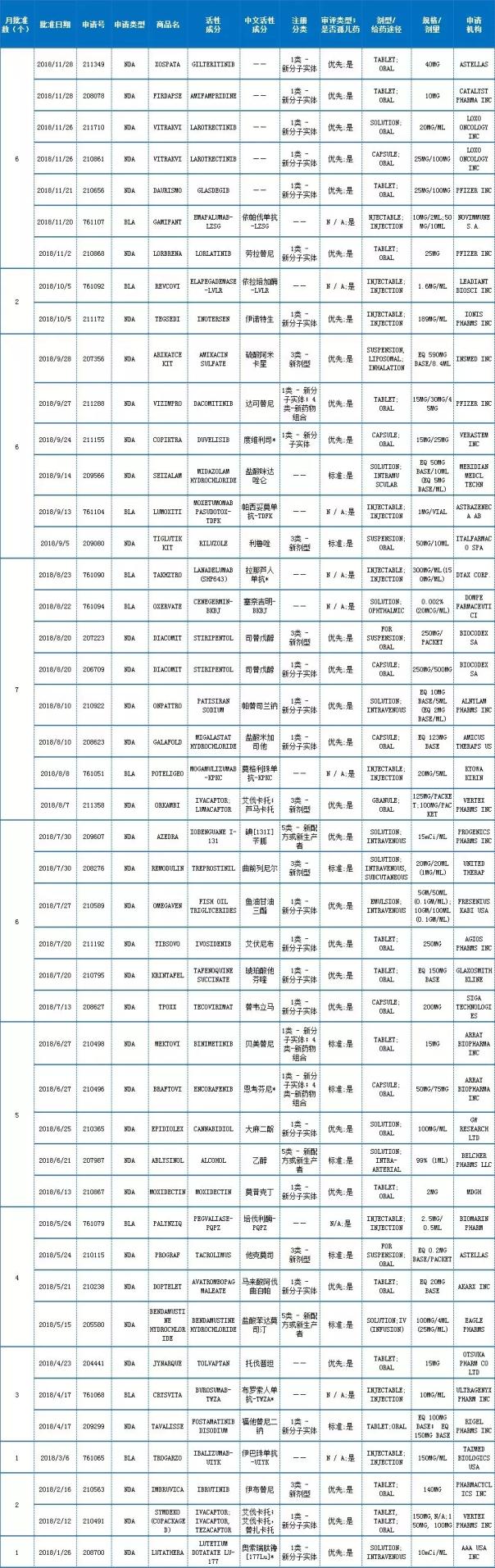
注:中文活性成分,依据INN命名原则翻译而来,“*”号部分翻译还有待商榷
数据来源:药智美国FDA药品数据库
信息来源:FDA官网、各药企官网
- 欧洲药品管理局受理安斯泰来Zolbetu
东京,2023年7月13日 -- 安斯泰来制药集团(TSE:...
- 暴增650.92%!哈药做对了什么?
疫情后,中药、OTC、保健品销售率先走向复苏,其中“老字号”...
- 新政赋能,力扬企业扬帆助推中医药科技发展
最近,国务院办公厅正式印发 《中医药振兴发展重大工程实施方案...
- 医药之家:多款1类新药相继获批上市!
随着国家创新发展战略的实施,近几年,中国制药业的创新成果正逐...